Các Enteropeptidase là một enzym của niêm mạc tá tràng có chức năng hoạt hóa các enzym của tuyến tụy. Nó đứng ở phần đầu của một chuỗi hoạt hóa toàn bộ các enzym tiêu hóa. Rối loạn chức năng enteropeptidase dẫn đến khó tiêu hóa và kém hấp thu thức ăn ở ruột non.
Enteropeptidase là gì?
Enteropeptidase là một loại men của niêm mạc tá tràng, có tác dụng kích hoạt các men tiêu hóa của tuyến tụy bằng cách kích hoạt trypsinogen thành trypsin.
Enteropeptidase được tiết ở viền bàn chải của niêm mạc tá tràng. Cụ thể, các tuyến của Liebekühn chịu trách nhiệm bài tiết. Các tuyến của liebekühn là chỗ lõm hình ống trong biểu mô ruột non và ruột già. Trong ruột non, chúng nằm giữa các nhung mao ruột non. Các tuyến, còn được gọi là Lieberkühn crypts, tiết ra một số lượng lớn các enzym ngoài enteropeptidase. Sự bài tiết của enteropeptidase được kích thích khi chyme, đã được tiêu hóa trước trong dạ dày, đi vào tá tràng. Riêng enzyme không ảnh hưởng đến các thành phần thực phẩm.
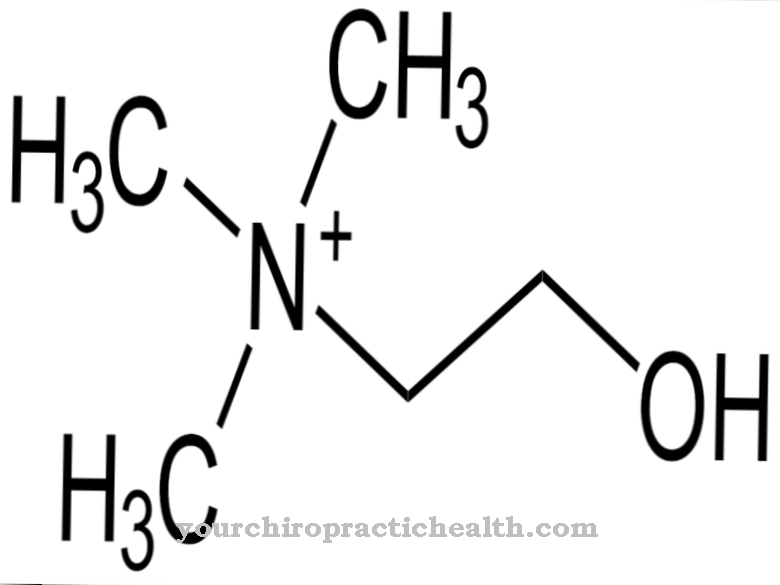
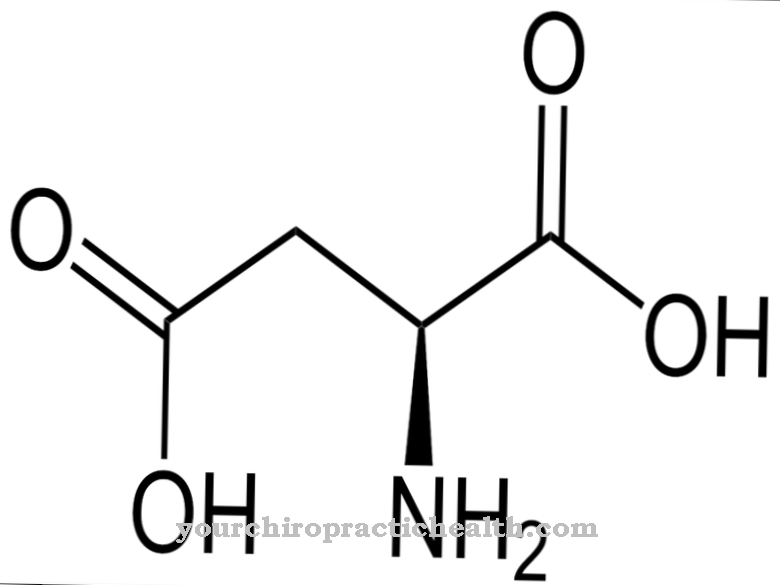
Chỉ có sự hoạt hóa của enzym trypsin mới thiết lập toàn bộ dòng thác hoạt hóa của các enzym tiêu hóa trong chuyển động. Enteropeptidase, giống như trypsin và các protease khác của tuyến tụy, là một protease serine. Trung tâm hoạt động chứa bộ ba xúc tác của axit aspartic, histidine và serine. Là một endopeptidase, enteropeptidase chỉ phân cắt các protein tại một số điểm đặc trưng nhất định với các mô hình nhận biết nhất định trong trình tự axit amin. Enzyme luôn phân cắt theo mô-típ nhận dạng Asp-Asp-Asp-Asp-Lys. Với trypsinogen, hexapeptide Val- (Asp) 4-Lys bị phân cắt, với trypsin được hình thành.
Chức năng, tác dụng và nhiệm vụ
Chức năng của enteropeptidase là kích hoạt các enzym tiêu hóa trong tuyến tụy. Nó chỉ bắt đầu bước đầu tiên của quá trình kích hoạt với việc chuyển đổi trypsinogen thành trypsin.
Đến lượt mình, trypsin là một serine protease phân cắt protein dựa trên cùng một mô-típ nhận dạng đặc trưng. Bây giờ nó tiếp tục kích hoạt trypsinogen của chính nó. Đồng thời, nó kích hoạt các enzym tuyến tụy khác từ các tiền chất tương ứng của chúng như chymotrypsinogen, pro-elastase, pro-carboxypeptidase, pro-phospholipase và proenteropeptidase. Enteropeptidase ban đầu cũng ở dạng proform không hoạt động. Khi chyme vào tá tràng, không chỉ proenteropeptidase mà cả duodenase cũng được tiết ra, kích hoạt proform của enteropeptidase. Sau khi bắt đầu thác hoạt hóa, trypsin tiếp nhận sự hoạt hóa của tất cả các enzym tuyến tụy bao gồm proenteropeptidase và trypsinogen.
Sự hoạt hóa của proenteropeptidase thành enteropeptidase diễn ra hiệu quả hơn thông qua hoạt động của trypsin hơn là thông qua duodenase. Sự hiện diện chính của các enzym tiêu hóa ở dạng không hoạt động là vô cùng quan trọng. Hoạt động của các protease nói riêng là không cụ thể. Tất cả các protein có chứa mô-típ nhận biết đặc trưng trong phân tử đều bị phân cắt thủy phân. Nếu các enzym được xúc tác hoạt động ngay lập tức, các protein của cơ thể đã được tiêu hóa trong tuyến tụy và ống tụy. Kết quả là, tuyến tụy sẽ tự tiêu biến. Sự hoạt hóa chỉ diễn ra ở tá tràng bên ngoài các tuyến ngoại tiết.
Các enzym có thể bắt đầu từ đây để phá vỡ các thành phần thức ăn mà không tấn công các mô của chính cơ thể. Để ngăn chặn các enzym bị kích hoạt sớm, một chất ức chế trypsin bổ sung hoạt động trong ống tụy. Tuy nhiên, trypsin đóng vai trò quan trọng đối với quá trình tiêu hóa. Một khi enzym này được kích hoạt, không thể ngừng hoạt động của tất cả các enzym tiêu hóa, bao gồm cả enteropeptidase.
Giáo dục, sự xuất hiện, thuộc tính và giá trị tối ưu
Giống như tất cả các protease serine, enteropeptidase cũng có tác dụng không đặc hiệu và phân cắt các protein bằng cách sử dụng một mô típ nhận dạng đặc trưng. Enteropeptidase bao gồm một chuỗi nhẹ và chuỗi nặng được liên kết với nhau bằng các cầu nối disulfide. Miền serine protease nằm trên chuỗi nhẹ.
Chuỗi nặng có khối lượng phân tử từ 82 đến 140 kilodalton, với khối lượng phân tử của chuỗi nhẹ là 35 đến 62 kilodalton. Cấu trúc chuỗi nhẹ của enteropeptidase tương tự như các protease serine khác là trypsin và chymotrypsin. Chuỗi nặng liên kết với màng và ảnh hưởng đến tính đặc hiệu của enzyme. Người ta nhận thấy rằng chuỗi ánh sáng cô lập có tác dụng tương tự đối với mô-típ nhận dạng đặc trưng - (Asp) 4-Lys-, nhưng tác dụng đối với trypsinogen thấp hơn đáng kể.
Bệnh & Rối loạn
Enteropeptidase ở người được mã hóa bởi gen ENTK trên nhiễm sắc thể 21. Một đột biến của gen này có thể dẫn đến các bệnh nghiêm trọng ở những đứa trẻ bị ảnh hưởng.
Enzyme này không còn có thể kích hoạt các men tiêu hóa khác. Các thành phần thức ăn không còn bị phá vỡ và do đó không còn có thể được hấp thụ bởi ruột non. Nó chủ yếu là vấn đề khó tiêu hóa (không đủ phân hủy), dẫn đến kém hấp thu các thành phần thực phẩm. Cơ thể không còn được cung cấp đầy đủ chất dinh dưỡng. Không phát triển mạnh, tăng trưởng còi cọc và các triệu chứng điển hình của sự thiếu hụt protein với sự phát triển của phù nề xảy ra. Đồng thời, ngoài protein, chất bột đường và chất béo kém hấp thu. Vì các thành phần thức ăn không được tiêu hóa sẽ đi vào ruột già và bị phân hủy ở đó bởi quá trình lên men và vi khuẩn hoạt tính, nên cũng xảy ra đầy hơi, tiêu chảy và đau bụng.
Cho đến nay, 15 trường hợp thiếu hụt enteropeptidase bẩm sinh đã được mô tả trên toàn thế giới. Tuy nhiên, các triệu chứng của tình trạng này phổ biến hơn nhiều. Thiếu men enteropeptidase không phải lúc nào cũng có. Vì trypsin đóng một vai trò quan trọng trong việc kích hoạt các enzym tiêu hóa, một khiếm khuyết hoặc thiếu hụt trypsin cũng dẫn đến các triệu chứng tương tự. Việc điều trị các bệnh này là như nhau trong cả hai trường hợp. Các enzym được sử dụng ở dạng hoạt hóa. Chắc chắn còn nhiều trường hợp thiếu men enteropeptidase không được chẩn đoán nữa.
Nếu chẩn đoán chắc chắn, enteropeptidase cũng có thể được thay thế. Sự thiếu hụt enteropeptidase cũng có thể gây ra thứ hai do các bệnh đường ruột nghiêm trọng.Các bệnh như bệnh celiac, ruột non ngắn, thiếu hụt lactase hoặc các bệnh khác cần được làm rõ trong chẩn đoán phân biệt.

.jpg)
.jpg)






.jpg)
.jpg)